MIDASEDAN® 15 – Midazolam 15mg/3mL
Descripción
MIDASEDAN® 15 – Midazolam 15mg/3mL – Solución Inyectable (Intravenosa / Intramuscular) – Ampolla por 3mL – Controlado FNE
Más detalles
- Marca:
- Sitio de acción:
- Acción terapéutica:
- Forma farmacéutica:
Solución
- Vía de administración:
Composición
Información de envase o empaque:
Condiciones de almacenamiento
Registro Sanitario INVIMA
Clasificación ATC
Condición de venta
Observaciones
Precaución
Forma farmacéutica: Solución inyectable
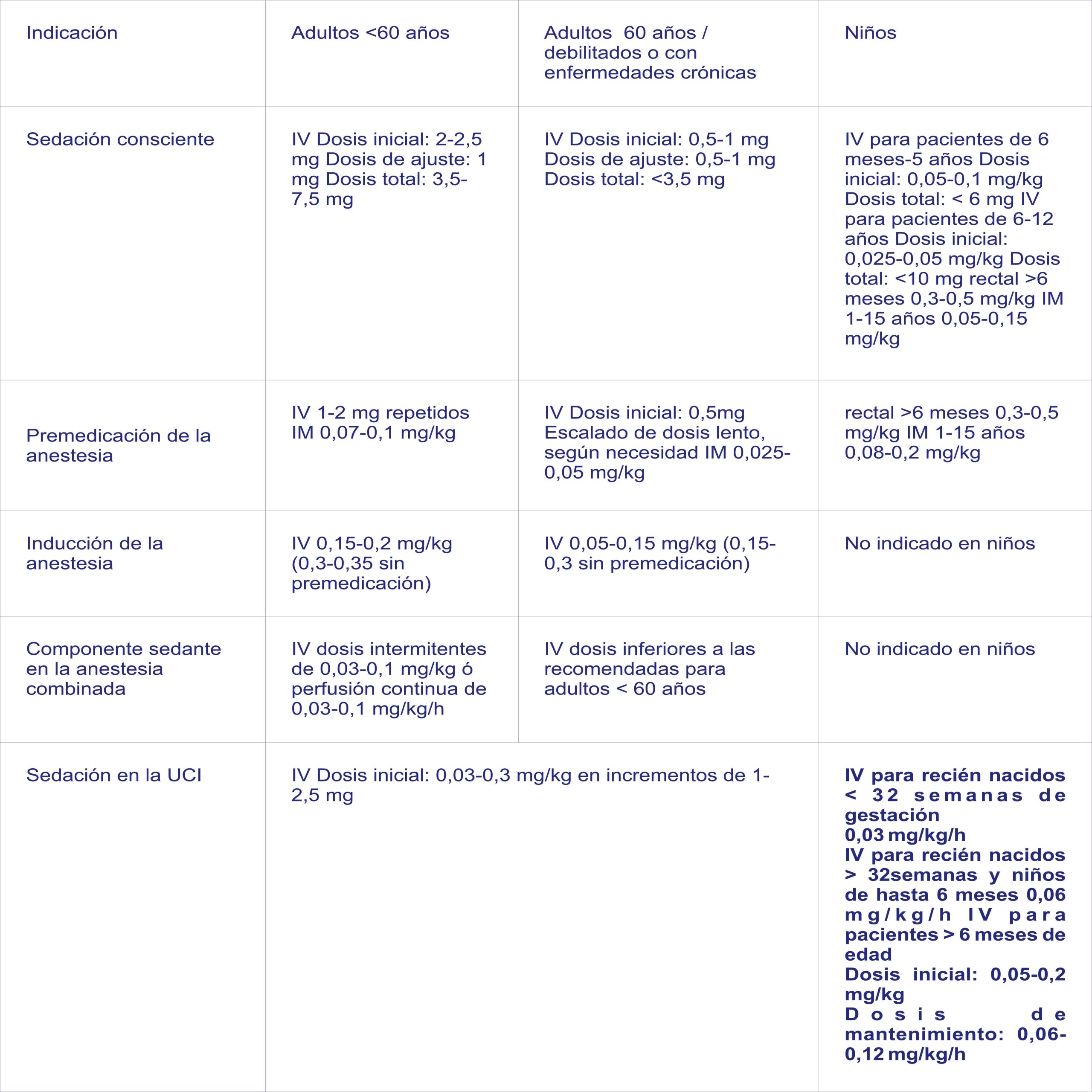
Indicaciones: Inductor del sueño de corta acción, indicado de la siguiente manera:
En adultos: – Sedación consciente antes y durante procedimientos diagnósticos o terapéuticos, con o sin anestesia local.
– Anestesia:
° Premedicación antes de la inducción de la anestesia.
° Inducción de la anestesia.
° Componente sedante en la anestesia combinada.
– Sedación en las unidades de cuidados intensivos (UCI)
En niños:
– Sedación consciente antes y durante procedimientos diagnósticos o terapéuticos, con o sin anestesia local
– Anestesia
° Predeterminación antes de la inducción de la anestesia.
– Sedación en las unidades de cuidados intensivos (UCI)
Contraindicaciones: Hipersensibilidad a las benzodiacepinas o a cualquiera de sus componentes.
Precauciones y Advertencias: Insuficiencia respiratoria, psicosis y depresión grave, embarazo y lactancia. Evitese conducir vehículos y ejecutar actividades que requieran ánimo vigilante.
Dosificación: Posología y forma de administración Midazolam es un potente sedante que requiere ajuste de la dosis y administración lenta. Se recomienda encarecidamente adaptar la dosis para obtener sin problemas el grado deseado de sedación según las necesidades clínicas, el estado físico, la edad y los fármacos concomitantes. En el caso de los adultos mayores de 60 años, los pacientes debilitados o con enfermedades crónicas y los pacientes pediátricos hay que determinar con precaución la dosis y tener en cuenta los factores de riesgo relacionados con cada paciente
Posología Para:
La Sedación Consciente: Para la sedación consciente antes de una intervención diagnóstica o quirúrgica se administrará midazolam por vía IV. La dosis debe individualizarse y adaptarse, y no debe administrarse en una inyección rápida en una sola embolada. El inicio de la sedación puede variar individualmente según el estado físico del paciente y las circunstancias detalladas de la posología (p. ej., velocidad de administración, cantidad de dosis). Si es necesario, pueden administrarse dosis posteriores con arreglo a las necesidades individuales. El medicamento empieza a actuar aproximadamente 2 minutos después de la inyección. Se obtiene un efecto máximo en un plazo de 5 a 10 minutos. Adultos: La inyección IV de midazolam debe administrarse con lentitud a una velocidad de aproximadamente 1 mg en 30 segundos. En el caso de los adultos menores de 60 años, la dosis inicial es de 2 a 2,5 mg, administrada 5 a 10 minutos antes de comenzar el procedimiento. Puede administrarse más dosis de 1 mg según las necesidades. Se ha observado que las dosis totales medias varían entre 3,5 y 7,5 mg. No suele ser necesaria una dosis total mayor de 5 mg. En el caso de los adultos de más de 60 años y los pacientes debilitados o con enfermedades crónicas, la dosis inicial debe reducirse a 0,5 – 1,0 mg, administrada 5-10 minutos antes de comenzar el procedimiento. Pueden administrarse más dosis de 0,5 a 1 mg según las necesidades. Debido a que en estos pacientes el pico efectivo puede alcanzarse más lentamente, el midazolam adicional debe ajustarse lenta y cuidadosamente. Habitualmente, no es necesaria una dosis total superior a 3,5 mg. Niños: Administración IV: la dosis de midazolam debe ajustarse con lentitud hasta obtener el efecto clínico deseado. La dosis inicial de midazolam debe administrarse durante 2 o 3 minutos. Se deben esperar de 2 a 5 minutos más para comprobar con exactitud el efecto sedante antes de iniciar el procedimiento o repetir la dosis. Si se necesita más sedación, hay que continuar ajustando la posología con pequeños incrementos hasta conseguir el grado de sedación apropiado. Los lactantes y los niños menores de 5 años pueden necesitar dosis considerablemente mayores (mg/kg) que los niños mayores y los adolescentes. Pacientes pediátricos menores de 6 meses: los niños menores de 6 meses son particularmente vulnerables a la obstrucción de las vías respiratorias y la hipoventilación. Por este motivo, no se recomienda el uso para sedación consciente en los niños menores de 6 meses. Pacientes pediátricos de 6 meses a 5 años de edad: dosis inicial de 0,05 a 0,1 mg/kg. Puede ser necesaria una dosis total de hasta 0,6 mg/kg para conseguir la sedación deseada, pero la dosis total no debe exceder de 6 mg. Las dosis superiores pueden asociarse con sedación prolongada y riesgo de hipoventilación. Pacientes pediátricos de 6 a 12 años: dosis inicial de 0,025 a 0,05 mg/kg. Puede ser necesaria una dosis total de hasta 0,4 mg/kg que no exceda de 10 mg. Las dosis superiores pueden asociarse con sedación prolongada y riesgo de hipoventilación. Pacientes de 12 a 16 años: la dosis debe ser la misma que para los adultos.
Administración rectal: la dosis total de midazolam suele variar entre 0,3 y 0,5 mg/kg. La administración rectal de la solución de la ampolla se realiza mediante un aplicador de plástico fijado en el extremo de la jeringa. Si el volumen que se ha de administrar es demasiado pequeño, se puede añadir agua hasta un volumen total de 10 ml. La dosis total debe administrarse de una vez, y hay que evitar la administración rectal repetida. No se recomienda el uso para niños menores de 6 meses, pues apenas se dispone de datos de esta población. Administración IM: las dosis empleadas varían entre 0,05 y 0,15 mg/kg. Habitualmente, no es necesaria una dosis total superior a 10,0 mg. Esta vía solo se debe utilizar en casos excepcionales. Es preferible la administración rectal, pues la inyección IM es dolorosa. En el caso de los niños que pesen menos de 15 kg no se recomiendan las soluciones de midazolam con concentraciones mayores de 1 mg/ml. Las concentraciones superiores deben diluirse hasta 1 mg/ml.
Posología Para La Anestesia:
Premedicación: La premedicación con midazolam administrado poco antes de un procedimiento produce sedación (inducción al sueño o letargo y disminución del miedo) y pérdida de memoria preoperatoria. El midazolam también se puede administrar en combinación con anticolinérgicos. Para esta indicación, el midazolam debe administrarse IV o IM profunda en una gran masa muscular 20 a 60 minutos antes de la inducción de la anestesia, o preferentemente por vía rectal en el caso de los niños. Es obligatorio una continua y estrecha monitorización de los pacientes después de administrar la premedicación, por la variabilidad de la sensibilidad interindividual y la posibilidad de síntomas de sobredosis. Adultos: Para la sedación prequirúrgica y para disminuir el recuerdo de los acontecimientos preoperatorios, la dosis recomendada para los adultos de estado físico I y II de ASA y menores de 60 años es 1-2 mg IV repetidos en caso necesario o de 0,07 a 0,1 mg/kg administrados IM. La dosis debe reducirse e individualizarse cuando el midazolam se ha de administrar a adultos mayores de 60 años, debilitados o con enfermedades crónicas. La dosis IV inicial recomendada es de 0,5 mg y debe ser ajustada lentamente según necesidad. Se recomienda administrar una dosis IM de 0,025 a 0,05 mg/kg. En el caso de administración concomitante con narcóticos, la dosis de midazolam debe reducirse. La dosis habitual es de 2 a 3 mg. Pacientes pediátricos: Recién nacidos y niños de hasta 6 meses de edad: El uso en niños menores de 6 meses no está recomendado debido a que los datos disponibles son limitados. Niños de más de 6 meses de edad: Administración rectal: La dosis total de midazolam, habitualmente de 0,3 a 0,5 mg/kg, debe administrarse 15 a 30 minutos antes de la inducción de la anestesia. La administración rectal de la solución de la ampolla se realizará mediante un aplicador de plástico fijado en el extremo de la jeringa. Si el volumen que se ha de administrar es demasiado pequeño, puede añadirse agua hasta un volumen total de 10 ml.
Administración IM: como la inyección IM es dolorosa, esta vía solo se utilizará en casos excepcionales. Se prefiere la administración rectal. Sin embargo, se ha demostrado que una dosis de 0,08 a 0,2 mg/kg de midazolam administrado IM resulta eficaz e inocua. En el caso de los niños de 1 a 15 años se requieren dosis proporcionalmente superiores a las de los adultos en relación con el peso corporal. En el caso de los niños que pesen menos de 15 kg no se recomiendan las soluciones de midazolam con concentraciones superiores a 1 mg/ml. Las concentraciones mayores deben diluirse hasta 1 mg/ml. Inducción Adultos: Cuando se emplea midazolam para la inducción de la anestesia antes de haber administrado otros anestésicos, la respuesta individual es variable. La dosis debe adaptarse al efecto deseado con arreglo a la edad y el estado clínico del paciente. Cuando se utiliza midazolam antes o en combinación con otros fármacos por vía IV o en inhalación para la inducción de la anestesia, se debe reducir significativamente la dosis inicial de cada medicamento, a veces a niveles tan bajos como el 25% de la dosis inicial usual. El nivel deseado de anestesia se consigue mediante un ajuste gradual. La dosis de inducción IV de midazolam debe administrarse lentamente en incrementos. Hay que inyectar cada incremento de no más de 5 mg durante 20 a 30 segundos, dejando 2 minutos entre los incrementos sucesivos. En adultos menores de 60 años premedicados, una dosis IV de 0,15 a 0,2 mg/kg suele ser suficiente. En adultos no premedicados menores de 60 años, la dosis puede ser mayor (0,3 a 0,35 mg/kg IV). Si es necesaria una inducción completa, pueden aplicarse incrementos de aproximadamente el 25% de la dosis inicial del paciente. En vez de ello, la inducción puede completarse con anestésicos inhalados. En los casos resistentes puede emplearse una dosis total de hasta 0,6 mg/kg para la inducción, pero dosis tan elevadas pueden prolongar la recuperación. En adultos mayores de 60 años premedicados, en pacientes debilitados o con enfermedades crónicas, la dosis debe reducirse significativamente, por ejemplo por debajo de 0,05 – 0,15 mg/kg administrados IV, en más de 20-30 segundos y dejando 2 minutos para que haga efecto. Los adultos no premedicados mayores de 60 años suelen necesitar más midazolam para la inducción; se recomienda una dosis inicial de 0,15 a 0,3 mg/kg. Los pacientes no premedicados con enfermedades generales graves u otros procesos debilitantes suelen requerir menos midazolam para la inducción. Habitualmente, una dosis inicial de 0,15 a 0,25 mg/kg.
Componente Sedante En La Anestesia Combinada: Adultos: Midazolam se puede administrar como un componente sedante en anestesia combinada mediante pequeñas dosis IV intermitentes (entre 0,03 y 0,1 mg/kg) o perfusión continua IV (entre 0,03 y 0,1 mg/kg/h), normalmente en combinación con analgésicos. La posología y los intervalos entre las dosis varían de acuerdo con la reacción de cada paciente. En el caso de los adultos mayores de 60 años y los pacientes debilitados o con enfermedades crónicas, son necesarias dosis de mantenimiento menores. Sedación En Las Unidades De Cuidados Intensivos: El grado deseado de sedación se alcanza mediante ajuste gradual del midazolam, seguido de perfusión continua o embolada intermitente, con arreglo a las necesidades clínicas, el estado físico, la edad y los fármacos concomitantes. Adultos: Dosis inicial IV. Se deben administrar 0,03 a 0,3 mg/kg con lentitud en incrementos. Cada incremento de 1 a 2,5 mg debe inyectarse durante 20 a 30 segundos, dejando 2 minutos entre los incrementos sucesivos. En el caso de los pacientes con hipovolemia, vasoconstricción e hipotermia, debe reducirse u omitirse la dosis inicial. Cuando el midazolam se administra con analgésicos potentes, estos deben aplicarse primero, de forma que los efectos sedantes del midazolam se puedan adaptar sin problemas al margen de la sedación causada por el analgésico. Dosis de mantenimiento IV: Las dosis pueden variar entre 0,03 y 0,2 mg/kg/h. En el caso de los pacientes con hipovolemia, vasoconstricción o hipotermia se debe reducir la dosis de mantenimiento. Hay que evaluar con regularidad el grado de sedación. Con una sedación prolongada puede aparecer tolerancia, lo que implicaría la necesidad de aumentar la dosis. Recién nacidos y niños de hasta 6 meses de edad: Midazolam debe administrarse en una perfusión IV continua, empezando con 0,03 mg/kg/h (0,5 μg/kg/min) en el caso de los recién nacidos con un periodo de gestación <32 semanas o 0,06 mg/kg/h (1 μg/kg/min) para los recién nacidos con un periodo de gestación >32 semanas y niños de hasta 6 meses. No se recomiendan dosis de choque intravenosas para niños prematuros, recién nacidos y niños de hasta 6 meses. La perfusión puede realizarse con mayor rapidez durante las primeras horas para establecer las concentraciones plasmáticas terapéuticas. Es necesario revisar atentamente y con frecuencia la velocidad de perfusión, sobre todo después de las primeras 24 horas, a fin de administrar la mínima dosis eficaz posible y reducir las posibilidades de acumulación del fármaco. Es necesario vigilar atentamente la frecuencia respiratoria y la saturación de oxígeno. Niños de más de 6 meses de edad: En el caso de los pacientes pediátricos intubados y ventilados se debe administrar con lentitud una dosis inicial de 0,05 a 0,2 mg/kg IV durante al menos 2 o 3 minutos para establecer el efecto clínico deseado. El midazolam no debe administrarse como una dosis intravenosa rápida. Tras la dosis inicial se debe proceder a una perfusión IV continua de 0,06 a 0,12 mg/kg/h (1 a 2 μg/kg/min). Si es necesario, se puede aumentar o disminuir la velocidad de perfusión (generalmente un 25% de la velocidad de perfusión inicial o posterior), o pueden administrarse dosis IV complementarias de midazolam para incrementar o mantener el efecto deseado. Al iniciar la perfusión de midazolam a pacientes con afectación hemodinámica, hay que ajustar la dosis inicial habitual en pequeños incrementos y vigilar al paciente para descartar inestabilidad hemodinámica, por ejemplo, hipotensión. Estos pacientes son también vulnerables a los efectos depresores respiratorios del midazolam y requieren una vigilancia cuidadosa de la frecuencia respiratoria y la saturación de oxígeno. En el caso de los lactantes prematuros, los recién nacidos y los niños que pesen menos de 15 kg no se recomiendan las soluciones de midazolam con concentraciones superiores a 1 mg/ml. Las concentraciones mayores deben diluirse hasta 1 mg/ml.
Uso En Poblaciones Especiales: Insuficiencia renal: En pacientes con afectación renal (aclaramiento renal <10ml/min) la farmacocinética del midazolam libre tras la administración de una dosis única intravenosa es similar a la de los voluntarios sanos. Sin embargo, después de una perfusión prolongada a los pacientes en las Unidades de Cuidados Intensivos, la duración media del efecto sedante en la población con insuficiencia renal se vio considerablemente incrementada debido a la acumulación del a-hidroximidazolam glucurónido. No existen datos específicos en pacientes con insuficiencia renal grave (aclaramiento renal inferior a 30ml/min) tratados con midazolam para la inducción a la anestesia. Insuficiencia hepática: La afectación hepática reduce el aclaramiento del midazolam IV con el consiguiente aumento de la vida media. Por lo tanto los efectos clínicos son mayores y más prolongados. La dosis necesaria de midazolam debe reducirse y debe realizarse una adecuada monitorización de los signos vitales.
Reacciones adversas: El midazolam debe utilizarse solamente cuando se disponga de equipos de reanimación adecuados (edad del paciente, tamaño de los instrumentos), dado que su Administración I.V. puede reducir la contractilidad del miocardio y provocar apnea. En raras ocasiones se han presentado graves efectos secundarios cardiorrespiratorios, consistentes en depresión de la respiración, apnea, parada respiratoria o parada cardíaca. Estas reacciones potencialmente mortales son más probables cuando se administra el preparado en inyección demasiado rápida o en una dosis. En caso de sedación consciente practicada por una persona no anestesista, se recomienda encarecidamente revisar las directrices más recientes.
Premedicación: Cuando se utiliza el midazolam como premedicación, es obligatorio vigilar adecuadamente al paciente, dado que cada persona tiene una sensibilidad distinta y pueden producirse síntomas de sobredosis. Pacientes de alto riesgo: Especial precaución requiere la administración de midazolam a pacientes de alto riesgo:
· Adultos mayores de 60 años
· Pacientes en estado crítico
· Pacientes con alguna insuficiencia:
– insuficiencia respiratoria
– insuficiencia renal
– insuficiencia hepática
– insuficiencia cardíaca
Estos pacientes de riesgo elevado requieren dosis más bajas (Posología y forma de administración) y deben permanecer en vigilancia continua para poder detectar todo signo precoz o alteración de las funciones vitales.
Criterios para el alta Después de recibir midazolam los pacientes deben recibir el alta del hospital o consultorio sólo si lo recomienda el médico y siempre en compañía de otra persona. Es recomendable que, tras recibir el alta, el paciente vaya acompañado hasta su casa.
Tolerancia (habituación): Se ha descrito cierta pérdida de la eficacia de Midazolam tras su uso para la sedación prolongada en las unidades de cuidados intensivos (UCI).
Síntomas de abstinencia: Dado que el riesgo de síntomas de abstinencia es mayor cuando se suspende bruscamente el tratamiento, especialmente tras una sedación prolongada (³ 2 – 3 días), se recomienda reducir la dosis gradualmente. Se han descrito los siguientes síntomas de abstinencia: cefalea, mialgia, ansiedad, tensión, inquietud, confusión, irritabilidad, insomnio de rebote, cambios del estado de ánimo, alucinaciones y convulsiones.
Amnesia: El midazolam causa amnesia anterógrada. La amnesia de larga duración puede originar problemas en los pacientes ambulatorios, que deben regresar a su domicilio tras la intervención.
Reacciones paradójicas: Tras la administración de midazolam se han observado reacciones paradójicas como agitación, movimientos involuntarios (convulsiones tónicas o clónicas y temblor muscular), hiperactividad, hostilidad, arrebatos de ira, agresividad, excitación paroxística y agresiones. Estas reacciones pueden producirse con dosis altas y cuando la inyección se administra con rapidez. Se han notificado casos aislados de estas reacciones en niños y, con dosis I.V. altas, en ancianos.
Eliminación alterada del midazolam: La eliminación del midazolam puede estar alterada en los pacientes tratados con inhibidores o inductores de la CYP3A4, por lo que podría ser necesario ajustar en consonancia la dosis de midazolam (véase Interacción con otros medicamentos y otras formas de interacción). La eliminación también puede experimentar un retardo en los pacientes con disfunción hepática o un gasto cardíaco reducido y en los neonatos (véase Uso en poblaciones especiales).
Prematuros: Dado el alto riesgo de apnea, se aconseja extremar las precauciones al sedar a prematuros de menos de 36 semanas gestacionales sin intubación traqueal. Debe evitarse la inyección rápida en prematuros de menos de 36 semanas gestacionales. Es preciso vigilar estrechamente la frecuencia respiratoria y la saturación de oxígeno.
Pacientes pediátricos menores de 6 meses: Los niños menores de 6 meses son especialmente vulnerables a la obstrucción de las vías respiratorias y la hipoventilación. Por ello, tiene una importancia fundamental que los incrementos de la dosis hasta el efecto clínico deseado sean pequeños y que se vigile estrechamente la frecuencia respiratoria y la saturación de oxígeno.
Uso concomitante de alcohol o depresores del SNC: Evítese la administración concomitante de midazolam con alcohol o depresores del SNC. Un uso concomitante tal podría incrementar los efectos clínicos de midazolam, incluidos posiblemente sedación grave, así como depresión respiratoria o cardiovascular clínicamente importante. Antecedentes de alcoholismo o drogadicción: Debe evitarse el uso de Midazolam en pacientes con antecedentes de alcoholismo o drogadicción. Otros: El uso de benzodiacepinas en pacientes con antecedentes de alcoholismo o drogadicción exige precaución. Como con cualquier otro fármaco depresor del SNC o de acción miorrelajante, es preciso extremar las precauciones cuando se administre midazolam a pacientes con miastenia grave.
Interacciones: Interacciones farmacocinéticas: El midazolam se metaboliza casi exclusivamente por medio de la enzima 3A4 del citocromo P450 (CYP3A4). Los inhibidores y los inductores de la CYP3A pueden incrementar y reducir las concentraciones plasmáticas y, consecuentemente, los efectos farmacodinámicos del midazolam. No se ha demostrado que otros mecanismos distintos a la modulación de la actividad de la CYP3A originen interacciones farmacocinéticas con los midazolam clínicamente importantes. Sin embargo, el desplazamiento agudo de la unión a la albúmina constituye una posibilidad teórica de interacción farmacológica con fármacos que alcancen concentraciones séricas terapéuticas considerablemente altas, como se ha conjeturado con el ácido valproico (véase más abajo). No se ha descrito ninguna alteración farmacocinética de otros fármacos por el midazolam. Se recomienda vigilar estrechamente los efectos clínicos y las constantes vitales del paciente durante el uso del midazolam, teniendo en cuenta que sus efectos clínicos podrían ser mayores y más duraderos tras la coadministración de un inhibidor de la CYP3A. En función de la magnitud del efecto inhibidor de la CYP3A, la dosis de midazolam puede reducirse en gran medida. Por el contrario, la administración de un inductor de la CYP3A puede requerir una dosis mayor de midazolam para obtener el efecto deseado. En caso de inducción e inhibición irreversible de la CYP3A (denominada “inhibición suicida”), el efecto sobre la farmacocinética de midazolam podría persistir entre varios días y algunas semanas tras la administración del inhibidor de la CYP3A. Ejemplos de inhibidores suicidas de la CYP3A son: antibacterianos (p. ej. claritromicina, eritromicina, isoniacida), fármacos contra el VIH (p. ej. inhibidores de la proteasa, delavirdina), antihipertensivos (p. ej. verapamilo, diltiazem), esteroides sexuales y moduladores de los receptores de esteroides (p. ej. gestodeno, raloxifeno) y diversos constituyentes vegetales (p.ej. bergamota, pomelo [toronja]). Al contrario que otros inhibidores suicidas (véase listado más abajo), el etinilestradiol / norgestrel utilizado como anticonceptivo oral y el zumo de pomelo (200 ml) no alteraron de forma importante las concentraciones plasmáticas del midazolam administrado I.V. La potencia inhibidora / inductora de los fármacos es variada. El antifúngico ketoconazol, un inhibidor muy potente de la CYP3A, incrementa unas 5 veces la concentración plasmática del midazolam I.V. El tuberculostático rifampicina pertenece a los inductores más potentes de la CYP3A y su coadministración con midazolam I.V. se traduce en un descenso de la concentración plasmática de esté en un 60%. El modo de administración del midazolam también influye en la magnitud del cambio farmacocinético debido a modulación de la CYP3A:
a) Con la administración intravenosa del midazolam cabe esperar una alteración de las concentraciones plasmáticas menor que tras la administración oral, dado que la modulación de la CYP3A no sólo afecta al aclaramiento sistémico, sino también a la biodisponibilidad oral del midazolam.
b) No existen estudios que hayan evaluado el efecto de la modulación de la CYP3A sobre la farmacocinética del midazolam tras la administración rectal e intramuscular. Dado que tras la administración rectal el fármaco elude en parte el hígado y que la expresión de CYP3A en el colon es menor que en el tubo digestivo alto, se supone que la alteración de las concentraciones plasmáticas de midazolam por modulación de la CYP3A será menor con la administración rectal que con la oral. Dado que con la administración intramuscular el fármaco penetra directamente en la circulación sistémica, cabe prever que el efecto de la modulación de la CYP3A sea similar al del midazolam intravenoso.
c) En consonancia con los principios farmacocinéticos, los estudios clínicos han puesto de manifiesto que, tras una dosis única I.V. de midazolam, el cambio en el efecto clínico máximo debido a la modulación CYP3A será leve, al tiempo que la duración del efecto podría prolongarse. Sin embargo, tras la administración prolongada de midazolam, tanto la magnitud como la duración del efecto aumentarán si existe inhibición de la CYP3A.
A continuación, se expone una lista con ejemplos de interacciones farmacocinéticas entre medicamentos tras la administración intravenosa de midazolam. Es importante señalar que cualquier fármaco con efectos moduladores de la CYP3A in vitro e in vivo tiene el potencial de alterar las concentraciones plasmáticas de midazolam y, por lo tanto, sus efectos. La lista recoge los datos de los estudios de interacciones farmacológicas con midazolam oral en el caso de que, para el fármaco coadministrado no existan datos sobre midazolam intravenoso. Sin embargo, como se mencionó más arriba, cabe esperar que la alteración de las concentraciones plasmáticas sea menor con el midazolam intravenoso que con la formulación oral.
Inhibidores de la CYP3A Antifúngicos azólicos: · El ketoconazol elevó 5 veces la concentración plasmática del midazolam intravenoso, mientras que la semivida terminal se incrementó aproximadamente 3 veces. La coadministración de ketoconazol, fuerte inhibidor de la CYP3A, y midazolam parenteral debe realizarse en una unidad de cuidados intensivos o un entorno similar que permita una estrecha vigilancia clínica y un tratamiento médico adecuado en caso de depresión respiratoria o sedación prolongada. Se considerará el escalonamiento y el ajuste posológicos, sobre todo si se administra más de una dosis I.V. única de midazolam. · Tanto el fluconazol como el itraconazol elevaron 2 – 3 veces la concentración plasmática de midazolam intravenoso, a la vez que aumentó la semivida terminal del itraconazol y el fluconazol 2,4 y 1,5 veces, respectivamente. · El posaconazol aumentó al doble, aproximadamente, la concentración plasmática de midazolam intravenoso. Macrólidos: · La eritromicina incrementó la concentración plasmática de midazolam intravenoso de 1,6 – 2 veces, a la vez que aumentó 1,5 – 1,8 veces la semivida terminal del midazolam. · La claritromicina elevó hasta 2,5 veces la concentración plasmática del midazolam, a la vez que aumentó 1,5 – 2 veces la semivida terminal.
Otros fármacos / Hierbas
-La atorvastatina presentó un aumento de la concentración plasmática de midazolam I.V. de, aproximadamente, 1,4 veces en comparación con el grupo de referencia.
· El sello de oro (Hydrastis canadensis) disminuyó la proporción del metabolito a-hidroximidazolam generado por la CYP3A respecto del midazolam en un 40% aproximadamente, lo que indica un efecto inhibidor de la CYP3A.
Inductores de la CYP3A
· Tras 7 días con 600 mg/día de rifampicina, la concentración plasmática de midazolam intravenoso disminuyó en un 60%. La semivida terminal se redujo en un 50 – 60%.
· Efavirenz: El aumento de 5 veces de la proporción del metabolito a-hidroximidazolam generado por CYP3A respecto del midazolam confirma el efecto inductor de la CYP3A del efavirenz.
Hierbas y alimentos
· El extracto de raíz de equinacea púrpura redujo la concentración plasmática de midazolam I.V. en un 20%, y la semivida, en un 42% aproximadamente.
· El hipérico (hierba de San Juan) disminuyó la concentración plasmática de midazolam en un 20 – 40%, y la semivida terminal, en un 15 – 17%.
Desplazamiento agudo de la unión a proteínas
· Ácido valproico: En una de las publicaciones se expone el desplazamiento de la unión a proteínas del midazolam por el ácido valproico como posible mecanismo de interacción farmacológica. La importancia clínica de este estudio se considera limitada por cuestiones metodológicas. Sin embargo, debido a la alta concentración plasmática terapéutica del ácido valproico, no puede excluirse el desplazamiento de la unión a proteínas del midazolam en la administración de dosis únicas, lo que se traduce en un efecto clínico del midazolam más patente.
Interacciones farmacodinámicas: La coadministración de midazolam con otros sedantes / hipnóticos, como el alcohol, probablemente se traduzca en mayores efectos sedantes / hipnóticos. Entre los ejemplos se cuentan los opiáceos/opioides (utilizados como analgésicos, antitusivos o tratamientos sustitutivos), antipsicóticos, otras benzodiacepinas utilizadas como ansiolíticos o hipnóticos, barbitúricos, propofol, ketamina, etomidato; antidrepresivos sedantes, antihistamínicos y antihipertensivos de acción central. El midazolam disminuye la concentración alveolar mínima de los anestésicos inhalatorios. La coadministración de midazolam con depresores del SNC, el alcohol inclusive, puede conllevar una potenciación de los efectos sobre la sedación, la respiración y la hemodinámica; por ello, han de vigilarse adecuadamente las constantes vitales. El alcohol ha de evitarse totalmente en los pacientes tratados con midazolam.
Vía de administración: Intravenosa o intramuscular
Condición de venta: Con fórmula médica